كيمياء: المحلول الحمضي و المحلول الأساسي
تعد
الحموض والقواعد من الأصناف المهمة للمركبات الكيميائية التي تأخذ مكانا ً بارزا ً
في حياتنا اليومية ، فهي توجد في كثير من الأغذية التي نتناولها كالخضروات
والفواكه مثل الليمون و البرتقال، كما توجد في المنظفات الكيميائية على اختلاف
أنواعها، وغيرها الكثير من المواد :
- المشروبات
الغازية وعصير الليمون من الأمثلة على
المواد التي تحتوي على حموض.
- القهوة
و الدم والمنظفات الكيميائية من الأمثلة على المواد التي تحتوي على قواعد.
المحلول
الحامضي:
كل
محلول مائي تكون قيمة الpH به أقل من pH الماء
النقي في نفس الدرجة الحرارية يسمى محلول حامضي.
ملاحظة
: بما أن قيمة pH الماء النقي في
الدرجة الحرارية 25 تساوي 7
يكون
تعريف المحلول الحامضي في الدرجة الحرارية 25: كل محلول مائي تكون قيمة الpH به اقل من 7
.
تأثير
التركيز على درجة الحموضة :
كلما
ازداد تركيز محلول حامضي تزداد درجة الحموضة والعكس صحيح .
مقارنة
حموضة المحاليل الحامضية:
تكون
المقارنة في هذا السياق بالاعتماد على قيمة الpH .
المحلول
المائي الحامضي الاكثر حموضة هو الذي تكون لديه قيمة pH هي
الاقل والعكس صحيح .
المحلول
القلوي:
كل
محلول مائي تكون قيمة الpH به أكبر من pH الماء
النقي في نفس الدرجة الحرارية يسمى محلول قلوي.
ملاحظة
: بما أن قيمة pH الماء النقي في
الدرجة الحرارية 25 تساوي 7
يكون
تعريف المحلول القلوي في الدرجة الحرارية 25: كل محلول مائي تكون قيمة الpH به اكبر من 7
.
تأثير
التركيز على درجة القلوية :
كلما
ازداد تركيز محلول قلوي تزداد درجة القلوية والعكس صحيح .
مقارنة
قلوية المحاليل القلوية:
تكون
المقارنة في هذا السياق بالاعتماد على قيمة الpH .
المحلول
المائي القلوي الاكثر قلوية هو الذي تكون لديه قيمة pH هي
الاكبر والعكس صحيح .
خصائص
المحاليل القلوية :
1- ملمسها زلق كملمس الصابون .
2- طعمها مر .
3- كاوية وتسبب الحروق والضرر للأنسجة .
4- موصلة للكهرباء
5- القواعد ل تتفاعل مع الفلزات لكن ليس بالنشاط نفسه الذي تتفاعل به
الحموض
6- تعطي ألوان مميزة مع الكواشف
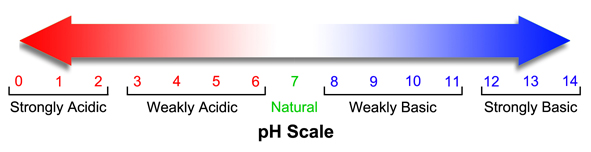
المخطط
التالي يبين علاقة الرقم الهيدروجيني بطبيعة المحلول :
علاقة
الرقم الهيدروجيني بكل من أيون الهيدرونيوم و أيون الهيدروكسيد.
إن
زيادة قوة المحلول الحمضي تؤدي إلى زيادة [H3O+]
مما يؤدي إلى
نقصان PH .
وإن
زيادة قوة المحلول القاعدي يؤدي إلى زيادة [-OH] مما يؤدي إلى زيادة PH .






.jpg)
.jpg)

%20(2).jpg)









Aucun commentaire:
Enregistrer un commentaire